top of page
Teoria corpuscular da matéria
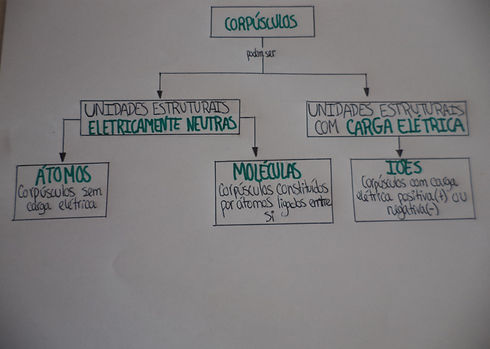
Toda a matéria é constituída por corpúsculos.
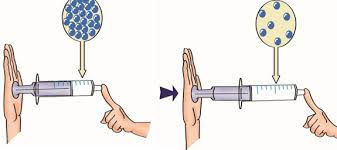
Na realidade estes corpúsculos podem ser átomos, moléculas e iões como podemos ver no gráfico a seguir.
A teoria corpuscular da matéria tem alguns princípios como:
-Toda a matéria é constituída por corpúsculos de dimensões muito reduzidas.
-Os corpúsculos estão em constante movimento.
-Quanto maior a temperatura de um corpo,mais rapidamente se movem os corpúsculos que o constituem.
-Entre os corpúsculos existe espaço vazio.
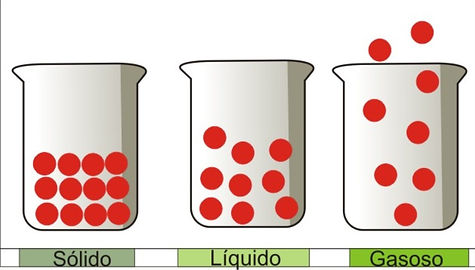
Liberdade de movimento dos corpúsculos
Estado Sólido
-Corpúsculos muito ordenados
-Próximos entre si
-Com reduzida liberdade de movimento
Estado Líquido
-Corpúsculos menos organizados do que estão no estado sólido
-Estão geralmente mais afastados entre si
-Maior liberdade de movimento
Estado Gasoso
-Estão ainda mais afastados do que os do estado liquido
-Têm grande liberdade de movimentos
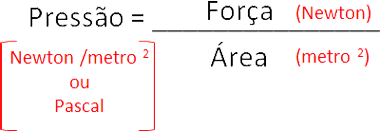
Pressão de um gás
Relação entre pressão,temperatura e volume de gases
Ao diminuir o volume aumenta a pressão se mantivermos constante a temperatura.
Ao aumentar a temperatura,aumenta a pressão se mantivermos o volume constante.
Ao aumentar a temperatura,aumenta o volume se mantivermos a pressão.
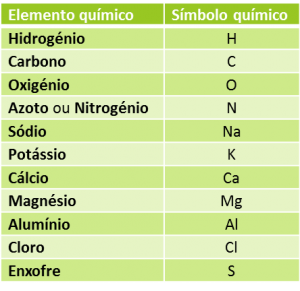
Átomos,elementos e símbolo químico
Teorias acerca da constituição da matéria na antiga Grécia:
Divisibilidade infinita Atomismo
A matéria pode dividir-se um A matéria é constituída por átomos,
número infinito de vezes que não se podem dividir
A constituição dos átomos
Os átomos são eletricamente neutros quando o número de eletrões é igual ao números de protões.
Os átomos e os elementos químicos
Átomos iguais correspondem ao mesmo elemento químico.Cada elemento corresponde a um símbolo químico.
Os símbolos químicos representam-se por uma letra maiúscula no início e uma letra minúscula no fim. Existe uns casos em que o símbolo químico é só uma letra maiúscula.
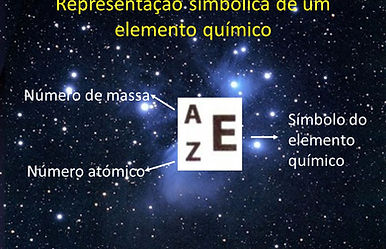
Designação de átomos e elementos químicos usando simbologia química
Quando se pretende designar um grupo de átomos utilizando simbologia química, deve escrever-se o seu número antes do símbolo que os representa.
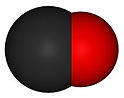
Moléculas e fórmulas químicas
O que são moléculas?
Os átomos têm tendência a ligar-se entre si.
Uma molécula é constituída por dois ou mais átomos ligados entre si.É eletricamente neutra e é uma das unidades estruturais constituintes da matéria.
Classificação de moléculas quanto ao número de átomos
Moléculas diatómicas-Moléculas constituídas por dois átomo Ex: dioxigénio.
Moléculas triatómicas-Constituída por três átomos Ex: dióxido de carbono.
Moléculas poliatómicas-Constituída por três ou mais átomos Ex: uma molécula constituída por um átomo de carbono e quatro átomos de hidrogénio.
Macromoléculas-Constituída por moléculas de grandes dimensões.
Fórmulas químicas
As moléculas representam-se por fórmulas químicas.
Uma fórmula química é constituída por:
-Símbolos químicos dos elementos constituintes.
-Número de átomos de cada elemento,escrito em índice.
Substâncias elementares
Substâncias elementares são constituídas por átomos de apenas um elemento.
Ex: Dicloro,Ozono e Fósforo branco.
Substâncias compostas
Substâncias compostas são substâncias cujas moléculas são constituídas por átomos de dois ou mais elementos.
Ex: Monóxido de carbono,dióxido de nitrogénio e Amoníaco.
Informação qualitativa e quantitativa de fórmulas químicas
Informação qualitativa-QUAIS os elementos químicos que estão presentes.
Informação quantitativa-Quantos átomos de cada elemento químico estão presentes.
Iões e compostos iónicos
Os sais são constituídos por iões.
Os iões podem ser iões positivos(catiões) ou negativos(aniões).
Um catião forma-se quando um átomo ou grupo de átomos cede(m) um ou mais eletrões.
Um anião forma-se quando um átomo ou grupo de átomos capta(m) um ou mais eletrões.
Fórmulas químicas de compostos iónicos
1)Representa-se simbolicamente,em primeiro lugar, o catião e em segundo o anião.
2)A soma algébrica de carga dos iões tem de ser nula.
3)A leitura da fórmula de substâncias iónicas faz-se ao contrário da sua escrita:
lê-se primeiro o anião e depois o catião.
Lei da conservação da massa
Antoine Lavoisier debruçou-se sobre o estudo da massa total das substâncias envolvidas nas reações químicas e verificou que esta permanece constante.
m(reagentes)que reage=m(produtos)prduzida
Reações de oxidação-redução
Reações de combustão
Nas reações de combustão tem que haver sempre um combustível que é o material que entra em combustão,um comburente que é o material que permite a combustão(O2) e a energia de ativação que é necessária para que a combustao se inicie(chama,calor ou descarga elétrica).
Ácidos e bases
-Têm sabor azedo
Propriedades das soluções ácidas -Corroem alguns metais,libertando di-hidrogénio
-Algumas soluções ácidas podem ser agressivas para o tecido vivo
Ex:(azeite,limão,vinagre,...)
-Têm sabor amargo
Propriedades das soluções básicas -São escorregadias ao tato
-Algumas soluções básicas podem ser agressivas ao tato vivo
Ex:(lixívia,detergente amoniacal,água do mar,...)
Átomo
Núcleo
Situado no centro do Átomo
Nuvem eletrónica
Região em torno do núcleo
Protões
Partículas com carga elétrica unitária positiva
Neutrões
Partículas sem carga elétrica
Eletrões
Partículas com carga elétrica unitária negativa


Sistema químico fechado onde ocorre uma reação química
A massa total não alterna
Rações de oxidação-redução
Reações de oxidação de metais
Reações de combustão
Respiração
Reações que ocorrem com libertação de grandes quantidades de energia.Envolvendo geralmente o aparecimento de chama,e se forem muito rápidas,podem ocorrer com explosão
Reações que ocorrem com libertação de energia que envolvem nutrientes com vista ao funcionamento
Reações que ocorrem com alguma libertação de energia e que têm como consequência a transformação de metais em óxidos metálicos
bottom of page